This is a SEO version of PAM_351. Click here to view full version
« Previous Page Table of Contents Next Page »147
NUEVOS FÁRMACOS
ASPECTOS MOLECULARES
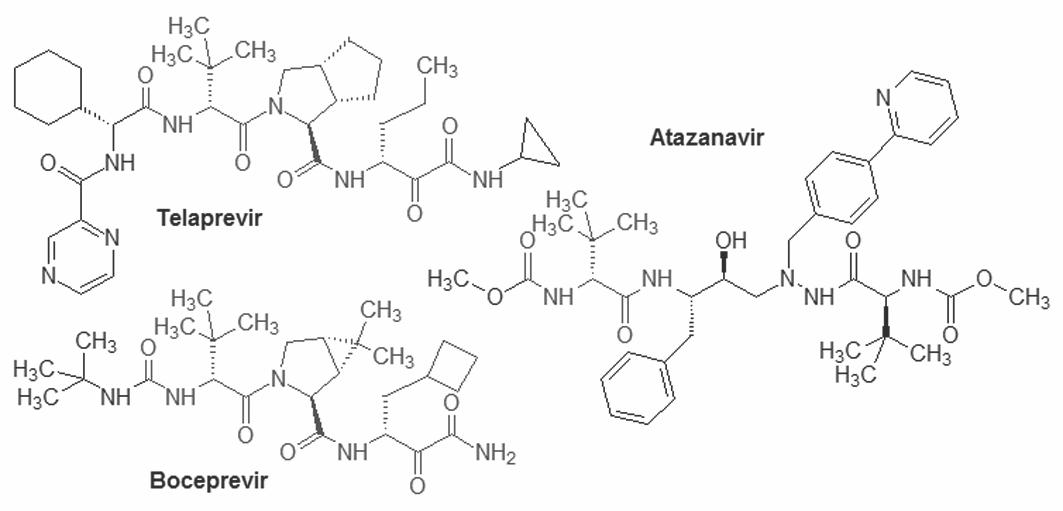
Telaprevir actúa como un falso sustrato para la proteasa NS3 del VHC. Emula la cadena peptídica que se une al sitio activo del enzima, formando un enlace covalente él y bloqueándolo. El fármaco está estrechamente relacionado con el boceprevir – tanto en términos moleculares como farmaco-lógicos – y es conceptualmente próximo a otros inhibidores de proteasas virales, como la del VIH; en concreto, telaprevir y boceprevir guardan una evidente familiaridad química con los antirretrovi-rales saquinavir y, especialmente, atazanavir.
EFICACIA Y SEGURIDAD CLÍNICAS
La efcacia y la seguridad clínicas del telaprevir en la indicación autorizada han sido adecuadamente contrastadas mediante tres ensayos clínicos de fase 3, multicéntricos, multinacionales, aleatorizados, doble-mente ciegos 3 y controlados con placebo, totalizando cerca de 2.300 pacientes con hepatitis C provocada por virus de la hepatitis C (VHC) de genotipo 1, diag-nosticada clínica e histológicamente, tanto naïve (no tratados previamente con fármacos antivirales especí-fcos) como tratados con anterioridad, pero con resul-tados no satisfactorios.
El estudio ADVANCE ( VX07-950-108; Jacobson, 2011 ) comparó dos regímenes posológicos de tela-
3 Salvo en uno de ellos, en los que hubo una aleatorización parcial de los pacientes, con asignación específca de trata-miento a uno de los grupos.
previr en 1.088 pacientes naïve de Norte y Sudamé-rica, Europa e Israel, siendo un 58% varones, 88% de raza caucásica, de 47 años de media (39% ≤ 45 años) y con un índice de masa corporal (IMC) medio de 27 kg/m 2 , siendo en un 40% <25. Un 6,5% de los pacientes presentaban cirrosis hepática, las va-riedades de genotipos era 1a (58%) y 1b (42%); la mediana de la carga viral de partida o basal (antes del tratamiento) era de 2.000.000 (6,3 log
10
) de co-pias de ARN viral/ml, estando un 23% por debajo de 800.000.
Los pacientes fueron aleatoriamente asignados a uno de las siguientes tres pautas posológicas: –– TPR12/PR12: 12 semanas con telaprevir ( T: 750 mg/8 h; oral) más peginterferón alfa 2a ( P: 180 µg/semana; SC) y ribavirina ( R: 500 mg/12 h para pacientes de <75 kg y 600 mg/12 h para ≥ 75 kg; oral), seguido de peginterferón alfa 2a y ribavirina durante otras 12 semanas adicionales (PR12), totalizando 24 semanas de tratamiento. El tratamiento con PR fue prolongado otras 24 semanas adicionales en los pacientes que no obtuvieron una respuesta viral rápida sostenida durante las primeras 4 y 12 semanas de trata-miento.
–– TPR8/PR16: 8 semanas con telaprevir más pegin-terferón alfa 2a y ribavirina, seguido de peginter-ferón alfa 2a y ribavirina durante otras 16 semanas adicionales, totalizando 24 semanas de trata-miento. El tratamiento con PR fue prolongado otras 24 semanas adicionales en los pacientes que no obtuvieron una respuesta viral rápida sostenida du-rante las primeras 4 y 12 semanas de tratamiento. –– PR48. 48 semanas con peginterferón alfa 2a y riba-virina.
Como variable principal de efcacia se utilizó la respuesta virológica sostenida , defnida como la inexistencia de carga viral detectable durante al menos 24 semanas tras el fnal del tratamiento (RVS24) planifcado inicialmente. Como varia-bles secundarias se establecieron la respuesta vi-rológica rápida (RVR), defnida como carga viral indetectable a la 4ª semana de tratamiento, y la respuesta virológica rápida extendida (RVRe), defnida como una carga viral indetectable du-rante la 4ª y la 12ª semana. También se determi-naron las tasas de recaída y los correspondientes valores de RVS24 en función de la carga viral basal, el estatus patológico hepático, la edad, el
This is a SEO version of PAM_351. Click here to view full version
« Previous Page Table of Contents Next Page »