This is a SEO version of PAM_350. Click here to view full version
« Previous Page Table of Contents Next Page »42 Panorama Actual del Medicamento
NUEVOS FÁRMACOS
de efectos signifcativos sobre otros receptores de la familia P2, aunque sí parece tener un cierta afnidad hacia algunos tipos de la P1, en particular sobre el subtipo A3 de receptores de adenosina, si bien se desconoce si tal afnidad se traduce en efectos ago-nistas o antagonistas. En cualquier caso, la afnidad hacia los receptores P2Y
12
es 50 veces mayor que hacia los receptores de tipo P1.
El ticagrelor inhibe la captación de adenosina por los eritrocitos humanos, posiblemente a través de un bloqueo de determinados transportadores de ade-nosina (en especial, los independientes del sodio). Bajo condiciones de hipoxia, el ticagrelor amplifca sus efectos sobre la captación eritrocitaria de ade-nosina, lo cual podría sugerir que el ticagrelor podría mostrar una mayor potencia en pacientes afectados por condiciones hipóxicas, como el propio síndrome coronario agudo. De hecho, algunas observaciones experimentales in vivo muestran que el ticagrelor aumenta el fujo sanguíneo coronario inducido por adenosina.
ASPECTOS MOLECULARES
Químicamente, el ticagrelor es el (1S,2S,3R,5S)- 3-(7-((1R,2S)-2-(3,4-difuorofenil)ciclopropilamino)- 5-(propiltio)-3H-(1,2,3)triazolo[4,5-d]pirimidin-3-il)- 5-(2-hidroxietoxi)ciclopentano-1,2-diol. Se trata, por tanto, de una molécula basada en un núcleo de tria-zolopirimidina que, en realidad, puede considerarse un análogo molecular del núcleo de la purina (imida-zopirimidina), presente en el ADP (adenosina bifos-fato). No solo esta similitud, sino también el anillo de ciclopentano del ticagrelor emula el resto glucídico del ADP, evidencian la relación estructural. La incor-poración en la posición 5 el anillo pirimidínico de un resto conteniendo azufre (propiltio) y la sustitución en el grupo amino en posición 3 del mismo anillo por un voluminoso agrupamiento (difurofenilciclo-propilo) son determinantes para el bloqueo del re-ceptor P2Y
12
, compitiendo con el sustrato agonista natural del mismo, el ADP.
Aunque la relación estructural es menos evi-dente con la familia de las tienopiridinas – en las que se encuadran la ticlopidina, el clopidogrel y el prasugrel – la idea de competición por similitud estructural también subyace. Sin embargo, una importante diferencia entre las tienopiridinas y el ticagrelor es que éste tiene un carácter de inhi-bidor reversible del receptor P2Y
12
, mientras que las tienopiridinas se unen irreversiblemente a éste, formando un complejo estable con el mismo. La reversibilidad del bloqueo por el ticagrelor implica que el receptor P2Y
12
de la membrana plaquetaria
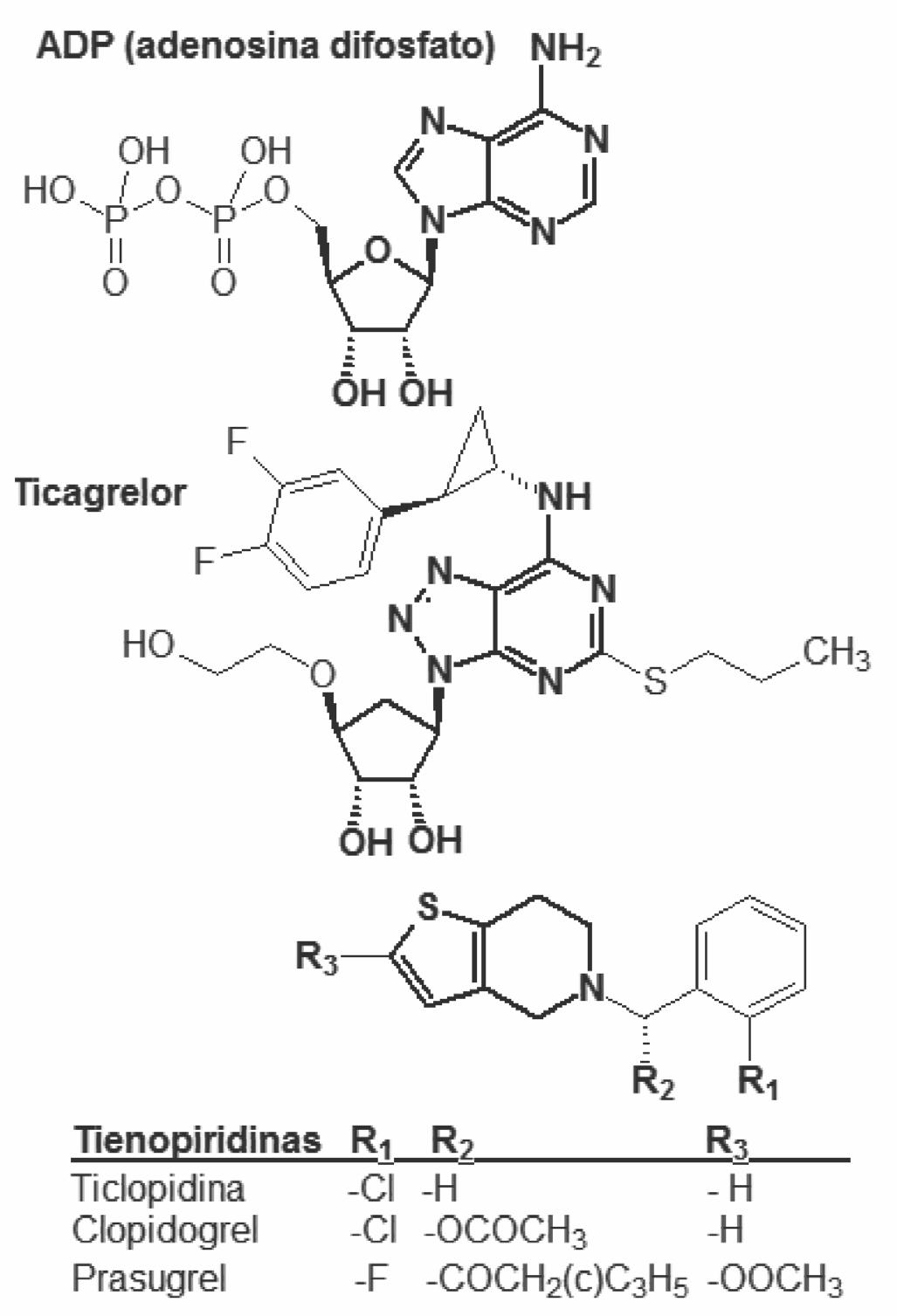
puede ser ocupado de nuevo por ADP y, por con-siguiente, volver a inducir y/o mantener la agrega-ción plaquetaria. Otro aspecto diferencial con las tienopiridinas es que el ticagrelor es activo por sí mismo, sin que se requiera una activación mediante un metabolismo hepático previo; no obstante, el principal metabolito del ticagrelor también es ac-tivo como antiagregante plaquetario.
EFICACIA Y SEGURIDAD CLÍNICAS
La efcacia y la seguridad clínicas del ticagrelor han sido adecuadamente contrastadas mediante en-sayos clínicos controlados con placebo y con compa-radores activos (clopidogrel). El ensayo clínico más importante es el PLATO ( PLATelet inhibition and pa-tient Outcomes ; Wallentin, 2009 ), un amplio estudio de fase 3, aleatorizado, multicéntrico y multinacio-nal (incluyendo pacientes de Norteamérica, Europa, África, Oriente Próximo y Australia), doblemente ciego y, en su caso, doblemente simulado, y contro-lado con clopidogrel.
Se incluyó en el estudio a un total de 18.624 pa-cientes que habían sido hospitalizados menos de 24
This is a SEO version of PAM_350. Click here to view full version
« Previous Page Table of Contents Next Page »