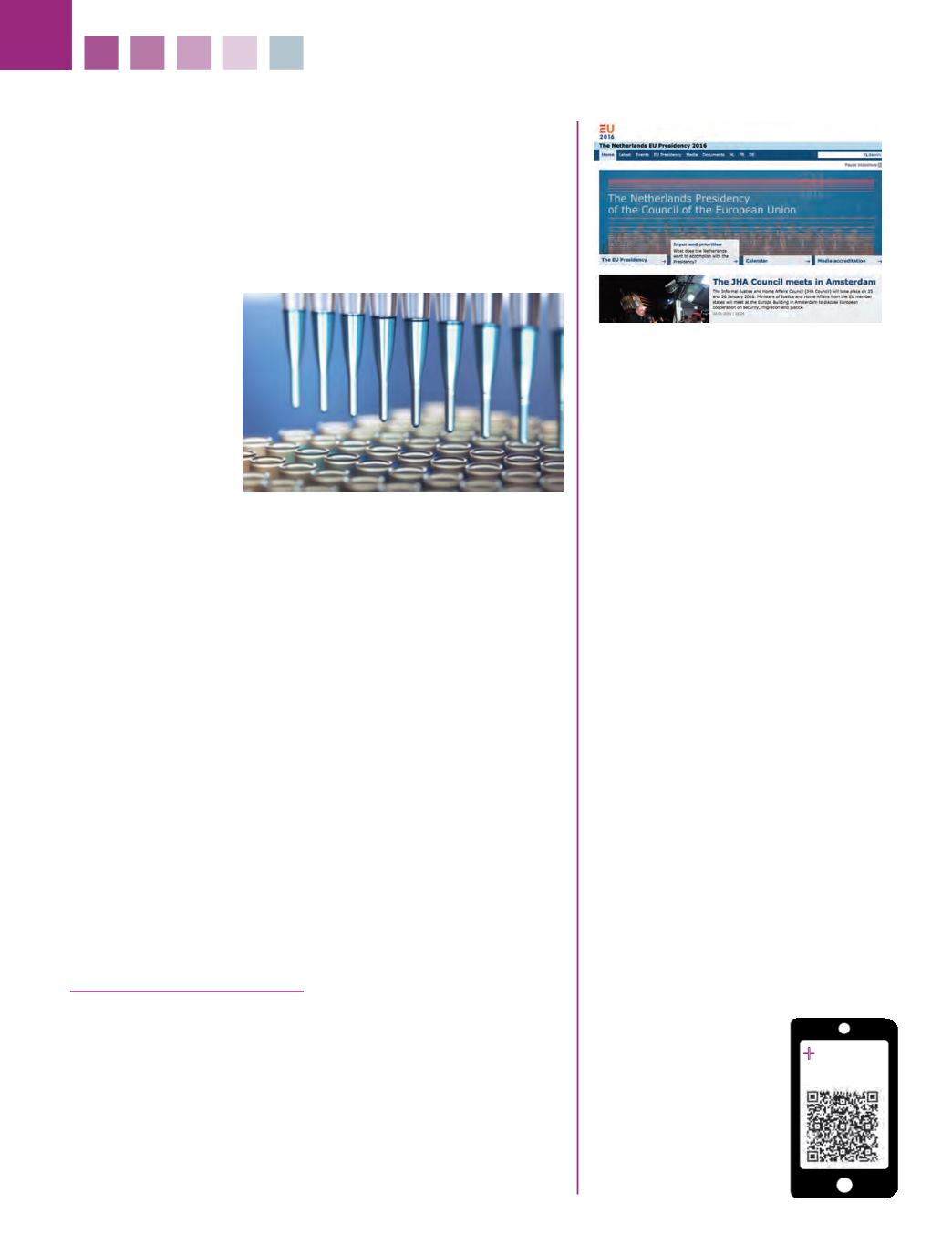
FARMACÉUTICOS N.º 412-
Eenro
2016
8
Actualidad
R
ecientemente se
ha hecho públi-
ca la hospitaliza-
ción en Rennes
(Francia) de seis
personas que estaban
participando en un ensa-
yo clínico de fase I, con
un medicamento experi-
mental, codificado como
BIA 10-2474, pertene-
ciente a los laboratorios
BIAL. Una de esas per-
sonas falleció, en tanto que otros cua-
tro permanecen hospitalizados (dos de
ellos han sido transferidos a hospita-
les de sus áreas de residencia) y uno
ya ha sido dado de alta. Por el momen-
to, se desconoce cuál podría haber sido
la causa de estos sucesos, teniendo en
cuenta que se trata de un ensayo clíni-
co en el que participaban 116 perso-
nas voluntarias sanas, de las cuales 84
habían recibido el tratamiento sin que
hasta ese momento se hubieran regis-
trado eventos adversos relevantes. El
primero de los casos fue comunicado
el día 11 de enero.
Es importante destacar que la regu-
lación y control de los ensayos clíni-
cos es extremadamente exigente en la
Unión Europea, como lo demuestra
el hecho de que, según declaraciones
de representantes de la Agencia Euro-
pea de Medicamentos (EMA) y de la
Agencia Española de Medicamentos y
Productos Sanitarios (AEMPS), se tra-
taría de la primera muerte ocurrida en
los más 12.500 ensayos clínicos de fase
I realizados en los últimos 20 años.
Perfil de seguridad
El proyecto de investigación se inició
en 2005 y los estudios con este fárma-
co se remontan a 2009. Los resulta-
dos obtenidos en los estudios preclíni-
cos demostraron un perfil de seguridad
y tolerabilidad que permitió, en junio
de 2015, obtener la aprobación en el
estudio de Fase I en seres humanos
con voluntarios sanos por la Autori-
dad Reguladora Francesa y el Comi-
té de Ética Francés, de conformidad
con las guías de Buenas Prácticas Clí-
nicas, con la Declaración de Helsinki
y de acuerdo con las leyes inherentes a
los ensayos clínicos.
El fármaco investigado en el ensayo
es un inhibidor de larga duración de la
acción del FAAH (ácido graso amida
hidrolasa - Fatty Acid Amide Hydro-
lase), y no un derivado cannabinoide,
como erróneamente ha aparecido en
varios medios de comunicación. Este
fármaco actúa incrementando los nive-
les de anandamida –un cannabinoide
endógeno– en el sistema nervioso cen-
tral y en los tejidos periféricos, lo que
se traduce en un efecto analgésico que
puede ir acompañado de otros diver-
sos efectos, tales como cambios en el
estado de ánimo, sedación y vasodila-
tación. Actualmente son diversos los
laboratorios que están investigando en
esta misma línea de los endocannabi-
noides, aunque por el momento no hay
ningún medicamento comercializado
que actúe específicamente a través de
esta vía bioquímica. Por otro lado, no
hay ningún otro ensayo en curso que
esté estudiando el BIA 10-2474.
Los estudios en fase I para un medi-
camento nuevo son el punto en el que
por primera vez se incorpora a perso-
nas en la experimentación. El objeti-
vo de los estudios en fase I es deter-
minar la dosis mayor de un nuevo
tratamiento que puede darse de for-
ma segura sin causar efectos secun-
darios graves. Aunque el tratamiento
se haya probado extensivamente en
estudios en animales, no siempre se
pueden predecir los efectos secunda-
rios en las personas.
✥
crobianos. Igualmente, se
harán avanzar los trabajos
sobre las propuestas relacio-
nadas con la salud y la segu-
ridad en el trabajo y la cali-
dad ambiental.
✥
Control de los ensayos clínicos en la UE
La seguridad de los ensayos
clínicos:
el caso del BIA 10-2474
Es importante destacar que la regulación y el control de los ensayos
clínicos es extremadamente exigente en la Unión Europea


